Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2 Viết phương trình phản ứng amoniac tác dụng với Kẽm hydroxide. Khi cân bằng phương trình thì cần hiểu rõ được tính chất, cách điều chế của chất đó, Bài học này sẽ củng cố kiến thức và giải đáp thắc mắc cho các em và các bạn đọc một cách chi tiết và chính xác nhất.
Đôi nét về Zn(OH)2 và cách điều chế :
Kẽm hydroxide là một hydroxide lưỡng tính. Công thức hóa học của nó là Zn(OH)2. Hợp chất màu trắng này rất ít tan trong nước. Là chất bột, màu trắng, không tan trong nước, nóng chảy ở 125oC.
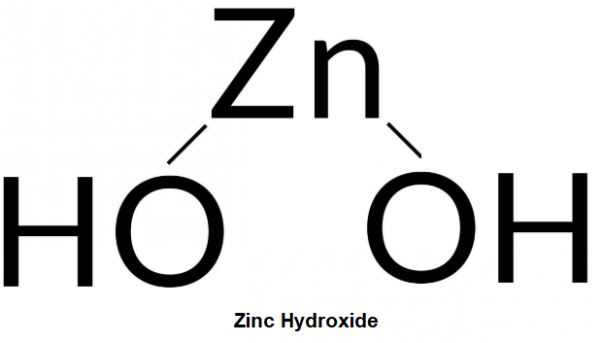
Kẽm hydroxide có thể được điều chế bởi phản ứng kẽm chloride hay kẽm sunfat với natri hydroxide vừa đủ:
ZnCl2 + 2NaOH → 2NaCl + Zn(OH)2↓
ZnSO4 + 2NaOH → Na2SO4 + Zn(OH)2↓
Một thao tác pha loãng natri hydroxide được sử dụng để kẽm hiđrôxít không bị hòa tan.
Phương trình hóa học cân bằng:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
Trong đó :
NH3 là Bazơ amoniac
Zn(OH)2 là Bazơ Kẽm hydroxide
[Zn(NH3)4](OH)2 là : Tetraamminezinc(II) hydroxide
Không cần điều kiện hay chất xúc tác kèm theo thì phương trình phản ứng vẫn xảy ra.
Thực hành thí nghiệm:
– Cho dung dịch NH3 tác dụng với Zn(OH)2
Hiện tượng nhận biết
Phương trình không có hiện tượng nhận biết đặc biệt.
Phương trình hóa học cân bằng này , bạn chỉ thường phải quan sát chất sản phẩm [Zn(NH3)4](OH)2 (Tetraamminezinc(II) hydroxide), được sinh ra
Hoặc bạn phải quan sát chất tham gia NH3 (amoniac), Zn(OH)2 (Kẽm hidroxit), biến mất.
Tính chất của Kẽm hydroxide :
Phản ứng với axit để tạo ra muối kẽm:
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
Hòa tan trong kiềm đặc và trong amonia tạo sản phẩm không màu:
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
Nhiệt phân: Zn(OH)2 → ZnO + H2O
Zn(OH)2 còn tác dụng với các axit hữu cơ như: Axit axetic, axit valeric,…
Xem thêm các phương trình phản ứng khác: